Fundamenteel onderzoek richt zich bij MS op de ziekteprocessen die zorgen dat iemand ziekteverschijnselen krijgt. Het gaat bij dit soort onderzoek om het krijgen van meer kennis en inzicht in de ziekte. Soms leiden nieuwe inzichten tot mogelijke nieuwe aangrijpingspunten voor medicijnen.
Immuuncellen
Dat immuuncellen een belangrijke rol spelen bij het ontstaan van laesies in de witte stof en daarbij bij de schubs die mensen met RRMS krijgen, is al lang bekend. DE cellen waar bij het MS Centrum Amsterdam onderzoek naar wordt gedaan zijn:
- Monocyten: dit zijn bloedcellen, maar zodra ze in het hersenweefsel zitten, heten ze macrofagen en zijn ze veranderd in een soort eetgrage Pac-Mans. De macrofaag eet letterlijk de myeline op.
- Natural Killer cellen (NK-cellen): deze cellen zitten vooral veel in de hersenen van mensen met progressieve MS. NK-cellen worden zo genoemd omdat zij in ons lichaam een natuurlijke afweerreactie hebben tegen virussen en bacteriën. Deze cellen zijn nog niet vaak in verband gebracht met MS. Wat hun rol is bij progressieve MS wordt onderzocht.
- B-cellen: Er zijn een aantal medicijnen voor MS die zorgen dat het aantal B-cellen in het bloed vermindert. Deze medicijnen zijn zeer effectief in het verminderen van schubs en zelfs bij het verminderen van de progressie.
Dankzij de nieuwste technieken, zoals CyTOF®, kan per individu een profiel van de immuuncellen gemaakt worden.
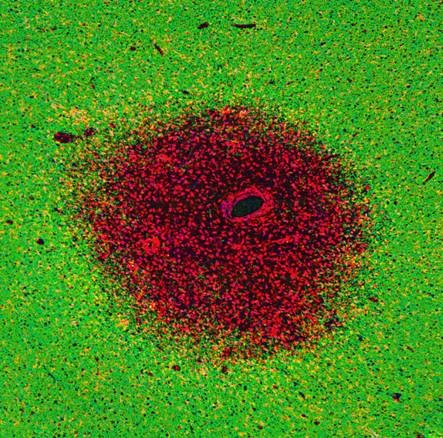 Foto: Alwin Kamermans - Immuuncellen (rood) komen via een bloedvat het hersenweefsel in en beschadigen de myeline (groen)
Foto: Alwin Kamermans - Immuuncellen (rood) komen via een bloedvat het hersenweefsel in en beschadigen de myeline (groen)
Hersencellen
Naast zenuwcellen bestaan de hersenen uit hersencellen. Dit zijn:
- oligodendrocyten; deze cellen maken de myeline;
- microglia; dit zijn de immuuncellen van de hersenen;
- astrocyten; dit zijn de steuncellen van de hersenen die 70% van het hersenvolume uitmaken.
Over microglia en astrocyten is inmiddels bekend dat ze zowel een beschermende als een ontstekingsbevorderend karakter kunnen hebben. Onderzoek van het MS Centrum Amsterdam richt zich op het stimuleren van het beschermende karakter.
Laesies in de grijze stof laten weinig ontsteking zien, daarom werd eerst gedacht dat immuuncellen geen rol spelen bij deze laesies, maar daar wordt nu anders over gedacht. Er worden veel laesies gezien in de buitenste laag van de hersenen, de cortex. Er lijken daar geen immuuncellen vanuit het bloed heen te gaan, maar we zien wel veel immuuncellen in de vliezen rondom de hersenen, de meningen. Het idee is dat de immuuncellen in de meningen een signaal afgeven aan de microglia cellen in de cortex. Hierdoor verliezen de microglia hun beschermende functie en veranderen ze in schadelijke microglia.
De bloed-hersenbarrière beschermt de hersenen tegen schadelijke stoffen. Het houdt ongewenste binnendringers tegen en zorgt dat voedingsstoffen wel het hersenweefsel bereiken. Bij MS functioneert de bloed-hersenbarrière niet goed. Met speciale modellen wordt onderzoek gedaan naar de bloed-hersenbarrière.
In het laboratorium wordt met de nieuwste technologieën vanuit menselijke stamcellen een soort mini-hersenen gekweekt. Zo ontstaat een kweekmodel dat dichter bij de mens staat dan de huidige ziektemodellen.
Laesies
Laesies in de witte stof worden al veel langer bestudeerd dan laesies in de grijze stof. Laesies in de grijze stof kregen pas na 1999 aandacht van onderzoekers, terwijl het fenomeen honderd jaar eerder al was beschreven. Bij het MS Centrum Amsterdam is een methode ontwikkeld om na het uitnemen van de hersenen van MS-donoren de hersenen af te beelden met een MRI-apparaat. De MRI-beelden worden vergeleken met wat onder de microscoop te zien is. Dit heeft veel kennis over de vorming van laesies en over hoe de verschillende laesies zichtbaar te maken zijn met MRI opgeleverd. Inmiddels worden zowel de afwijkingen in de witte als de grijze stof gezien als belangrijke kenmerken bij MS. Er zijn wel grote verschillen tussen de laesies in ontstaanswijze en effect op ziekteverschijnselen.
Onderzoekers van het MS Centrum Amsterdam hebben ontdekt dat er schade kan zijn aan de myeline nog voordat er een laesie zichtbaar is. De onderzoekers kijken in het hersenweefsel of deze myelineblaren het begin van een laesie zouden kunnen zijn en hoe we deze zo vroeg mogelijk in kaart kunnen brengen, bijvoorbeeld met geavanceerde MRI.
Ook wordt er met MRI gekeken naar het in kaart brengen van de zogenaamde “sluimerende” MS-laesies in de hersenen, door middel van het meten van ijzer aan de randen van deze laesies.
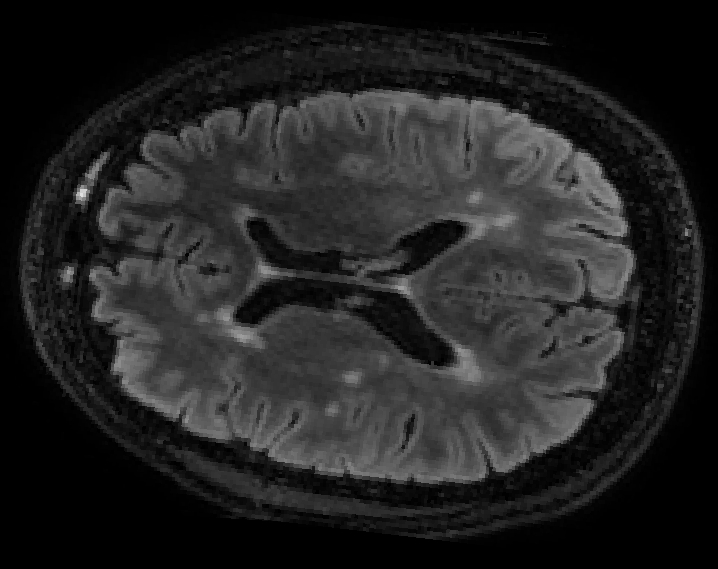 Foto: MSCA - MRI-scan met MS-laesies zichtbaar als witte plekken
Foto: MSCA - MRI-scan met MS-laesies zichtbaar als witte plekken
Netwerk
Beschadigingen aan de verschillende hersengebieden en vezelbanen tussen gebieden worden bestudeerd met structurele MRI. Met functionele MRI (fMRI) en magnetoencefalografie (MEG) wordt vervolgens onderzocht hoe de verschillende gebieden anders met elkaar gaan praten door de schade. Bij dit onderzoek wordt gekeken naar de hersenen als netwerk. Het hersennetwerk kan vergeleken worden met het treinnetwerk. Sommige stations, zoals Amsterdam, zijn heel belangrijk. Als er een storing is op zo’n station, heeft dat effect op al het treinverkeer. Dit is ook wat er bij MS gebeurt.
Sommige hersengebieden zijn belangrijker dan andere om het hele hersennetwerk in de lucht te houden. De thalamus is zo’n belangrijk schakelstation in de hersenen dat heel belangrijk is voor bijvoorbeeld het cognitief functioneren, maar ook voor veel andere functies. Bij mensen met MS met cognitieve stoornissen is vaak thalamuskrimp te zien. Deze krimp lijkt een graadmeter te zijn voor de totale hoeveelheid schade aan de snelwegen in de hersenen. We denken nu dat progressie van de ziekte vooral samenhangt met een opeenstapeling van dit soort netwerkschade. De hersenen zijn in het begin in staat om functies te behouden als er verbindingen wegvallen, bijvoorbeeld doordat de betrokken hersengebieden harder gaan werken en taken van beschadigde gebieden overnemen. Echter, als de ziekte vordert, neemt de schade aan belangrijke grijze stof structuren, zoals de thalamus, teveel toe en lijkt het compenseren niet langer mogelijk. Dan ontstaat er een “netwerk collaps” wat een voorbode lijkt te zijn van de versnelde achteruitgang bij progressieve MS. Wij bestuderen hoe we dit kantelpunt van het netwerk beter kunnen begrijpen en vooral hoe we dit kunnen voorspellen en voorkomen.’